王贵强:HBsAg定量在抗病毒治疗中的意义
作者 北京大学第一医院感染疾病科暨肝病中心 王贵强 香港中文大学胃肠病和肝病科 陈力元
王贵强教授
“在干扰素为基础的治疗过程中,乙肝病毒表面抗原(HBsAg)定量可以预测长期治疗应答;HBsAg定量联合乙型肝炎病毒(HBV)DNA可以考虑作为停药指标,而单一HBsAg定量尚不足以作为停药指标。此外,HBsAg定量变化对个体化治疗的价值(如延长疗程)尚待研究。在核苷(酸)类似物(NA)治疗中,现有数据提示,HBsAg也可能作为停药指标,或者预防治疗复发的有效指标,但是还需要扩大样本量进一步研究。”
在干扰素治疗中,HBsAg定量对疗效的预测价值
为什么需要预测患者对干扰素治疗的应答?
在干扰素治疗中,疗效与最终转归的关系非常密切。干扰素治疗后出现持久应答的患者,其肝癌等肝病终末期事件的发生风险会大幅度降低。因此,如何早期判断干扰素疗效,被广泛关注。由于慢性乙肝(CHB)患者对干扰素治疗的持续应答率约30%~40%,同时干扰素存在有副作用、使用不方便、费用等问题,因而在治疗过程中,我们希望通过一些指标评价干扰素是否可能有效——如果可能有效,那么会给我们信心继续使用;如果效果不好,那就尽早停药或调整为其他的治疗。
“经典”预测指标及结果
既往有很多针对CHB患者基线临床指标的预测价值方面的研究。比较经典的是巴斯特(Buster)等于2009年发表在《胃肠病学》(Gastroenterology)杂志上的研究,评价了4个基因型(A、B、C、D)以及基线丙氨酸氨基转移酶(ALT)、HBV DNA水平在预测疗效中的作用。结果显示,基线ALT>2 倍正常值上限(ULN)且HBV DNA<109copies/ml的患者,在治疗1年停药观察半年后,A基因型CHB患者中,54%获得持久病毒学应答(SVR,HBeAg消失且HBV DNA<2000 IU/ml);B基因型患者27%获得SVR。这一研究提示,基线ALT>2 ULN且HBV DNA<109copies/ml的患者,会获得更好的治疗应答。
治疗中HBsAg定量与停药后疗效的相关性
在HBeAg(+)CHB患者中,HBsAg下降可以反映cccDNA的变化和肝内HBV DNA水平
陈(Chan)等研究(Clin Gastroenterol Hepatol 2007)显示,在e抗原(HBeAg)阳性(+)患者中,HBsAg定量水平的下降与共价闭合环状DNA(cccDNA)水平下降有显著相关性(R=0.68,P<0.0001)。同样,HBsAg下降与肝组织中HBV DNA的下降也有非常明确的正相关(R=0.65,P<0.0001)。
在(治疗)12周或24周HBsAg定量下降的程度和幅度,可以预测治疗结束后HBeAg血清学转换率
陈(Chen)等回顾性研究发现,干扰素治疗1年停药随访半年时的治疗转归与治疗过程中HBsAg定量关系密切。HBsAg下降幅度越大,HBeAg抗原的血清学转换发生率就越高。12周、24周、48周时HBsAg下降的幅度,都可预测治疗1年停药半年的HBeAg血清学转换的发生率。同时,多项研究表明,HBsAg水平下降和HBeAg血清学转换相关。索那维尔(Sonneveld)等的研究中,在12周时HBsAg没有下降的31%的人群中,最终出现SVR的比例只有3%;在24周的时候,HBsAg如果没有下降,那么治疗结束时,只有8%出现SVR(Hepatology 2010)。皮拉维苏(Piratvisuth)等的研究得出类似结果。如果患者在12周时HBsAg没有明显下降,最终只有18%出现SVR(Hepatology 2011)。刘(Lau)等研究发现,干扰素治疗患者如果在12周时HBsAg>20000 IU/ml,SVR发生率16%,24周时HBsAg>20000 IU/ml,SVR为15%。相反,如果患者在12周时,HBsAg<1500 IU/ml,那么在治疗结束停药随访半年时,将有57%的患者出现HBeAg血清学转换,在24周时HBsAg<1500 IU/ml,将有54%患者出现HBeAg血清学转换。
这项研究也提示,HBsAg的变化可以预测治疗结束停药随访半年的HBeAg血清学转换(EASL 2009)。Chan等以HBsAg定量300 IU/ml作为界值。治疗24周时23%患者HBsAg<300 IU,继续干扰素治疗至48周停药随访24周,有62%患者出现HBeAg血清学转换(SVR);如果患者在24周时,HBsAg<300 IU/ml且下降大于1个log值,那么最终有75%的患者出现HBeAg血清学转换(Aliment Pharmacol Ther 2010)。以上研究提示,在12周或24周HBsAg定量下降的程度和幅度,可以预测治疗结束后HBeAg血清学转换率。
联合指标对治疗反应的预测价值
联合HBsAg和HBV DNA提高预测价值
以亚太地区比较多的B型和C型基因型为例,基线预测指标(包括基因型、ALT水平、年龄、性别等)对联合应答(HBeAg消失,HBV DNA<2000 IU/ml)预测的曲线下面积(AUC)是0.60(基因型B)和0.67(基因型C)。而24周时联合HBsAg定量和HBV DNA下降的情况,可以更好的预测疗效[12周:AUC值0.76(基因型B),0.80(基因型C);24周:AUC值0.79(基因型B),0.82(基因型C)]。该研究提示,联合HBsAg定量和HBV DNA在治疗12周或24周时的变化和下降幅度,可以更好预测干扰素治疗1年停药半年HBeAg消失发生率。若12周时患者HBsAg定量和HBV DNA下降幅度都是比较小,其最终出现持久应答的比例低;而12周时HBsAg定量和HBV DNA下降幅度越大,患者出现持久应答的比例也越高(Hansen和Chan等,AASLD 2012)。
联合HBsAg和HBV DNA预测持续应答,阴性预测值(NPV)为98%
一组270例使用聚乙二醇干扰素治疗患者中,分别用HBsAg定量和HBV DNA单独或联合指标预测持久应答(Piratvisuth和Chan等,EASL 2012)。结果显示,在治疗24周时,如果HBsAg≤20000 IU/ml,那么在治疗结束停药随访半年时,将有26%的患者出现联合应答(HBeAg血清学转换且HBV DNA<10000 copies/ml)。相反,如果患者在24周时HBsAg>20000 IU/ml,只有4%的患者出现联合应答。联合HBsAg定量和HBV DNA水平,若患者治疗24周时HBsAg≤20000 IU/ml且HBV DNA≤100000copies/ml,在治疗结束停药随访半年时,将有39%出现联合应答。相反,如果患者在24周时,HBsAg>20000 IU/ml并且HBV DNA>100000 copies/ml,只有2%将出现联合应答,NPV为98%。由此,如果患者在治疗24周时HBsAg>20000 IU/ml且HBV DNA>100000 copies/ml,需要考虑停用干扰素,调整治疗方案。
HBsAg定量在HBeAg(-)CHB中的预测价值
HBsAg下降在HBeAg(-)患者中的疗效预测
一项欧洲研究,也同样是把HBsAg下降作为HBeAg(-)患者疗效预测的指标(Marcellin,APASL 2010)。结果显示,如果患者使用聚乙二醇干扰素治疗12周时HBsAg下降≥10%,那么停药后随访,有47%的患者HBV DNA<4 log;相反,如果患者在12周时HBsAg下降<10%,仅有16%出现SVR。此项研究的终点观察指标是5年HBsAg消失的发生率。如果治疗12周时HBsAg下降≥10%,将有23%患者在5年时HBsAg消失;如果HBsAg下降<10%,5年之后HBsAg消失发生率7%。这两组之间都存在显著差异,提示12周HBsAg下降可以预测干扰素治疗的HBV DNA持久应答以及HBsAg长期消失的情况。在治疗24周时同样也有类似的结果。24周时,如果HBsAg下降≥10%,停药随访半年,将有43%患者HBV DNA<4 log,反之,只有13%。HBsAg的5年消失情况也类似,如果24周时HBsAg下降≥10%,22%的患者在5年时HBsAg消失,相反只有4%。所以,从HBsAg定量在12周24周下降的幅度,可以预测治疗结束以后持久病毒学应答以及长期HBsAg消失的发生率。
联合HBsAg定量和HBV DNA水平在HBeAg(-)患者中的疗效预测
在另一项研究中,102例HBeAg(-)患者使用聚乙二醇干扰素联合或不联合利巴韦林治疗48周。如果在12周HBsAg下降且HBV DNA下降≥ 2 log IU/ml,那么最终将有39%患者在72周时HBV DNA<4 log IU/ml;如果HBsAg下降,但DNA下降<2 log IU/ml,72周时只有25%患者HBV DNA<4 log IU/ml;相反,如果HBsAg没有下降且DNA下降<2 log IU/ml,到72周时所有患者HBV DNA均大于4 log IU/ml,这种情况应该考虑调整治疗(Rjickborst 等,J Hepatol 2010)。
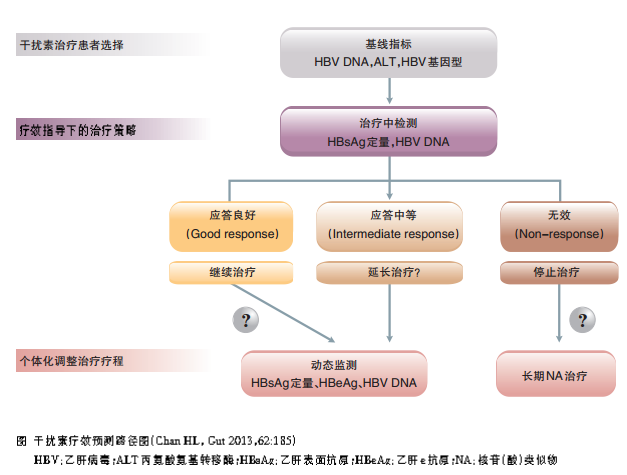
干扰素治疗中,疗效预测的策略
在干扰素治疗中,应使用不同层次的疗效预测指标指导临床治疗。
基线指标(如基线的ALT水平、HBV DNA水平、年龄、性别、基因型等)可作为初始治疗预测。而更重要的是在治疗过程中进行预测,可以应用HBsAg定量和HBV DNA水平作为联合预测指标。如果治疗过程中,患者HBsAg定量和HBV DNA应答都很好,则有信心继续使用干扰素治疗,大部分会获得很好的治疗应答;相反,如果患者HBsAg定量和HBV DNA应答差,则需要调整治疗方案,考虑停用干扰素改用核苷类似物治疗,或联合治疗(图)。这方面非常值得进一步研究,包括预测时间点、预测界值等。
治疗结束时,血清学指标对持续免疫控制的预测
Chan等研究了130例HBeAg(+)的CHB患者使用干扰素治疗,观察治疗结束时,联合指标预测疗效的价值(APASL 2012)。将HBsAg定量和HBeAg的血清学转换作为联合预测指标,在治疗结束的时候,如果HBsAg定量<100 IU/ml且发生HBeAg的血清学转换,最终停药随访半年有92%患者保持HBeAg血清学转换,即持久应答。另一项布鲁内托(Brunetto)等在欧洲的研究显示,治疗48周时HBsAg定量也可以预测持久应答和HBsAg最终消失的情况(Hepatology,2009)。
在HBeAg(-)CHB使用聚乙二醇干扰素治疗的患者中,48周时HBsAg定量<10 IU/ml的患者,80%出现SVR;相反,在48周时HBsAg仍大于5000 IU/ml患者中,无人出现持久的病毒学应答。此外,作者进一步研究指出,以HBsAg定量380 IU/ml作为界值,对最终HBsAg消失的预测敏感性为74%,特异性100%,NPV达到100%,阳性预测值(PPV)为25%,提示HBsAg定量可以作为停药的指标。
在核苷(酸)类似物治疗中, HBsAg定量对疗效的预测价值
基线HBsAg定量不能预测持久病毒学应答
在Chan等的研究中,HBeAg(+)的CHB患者,使用单药的替诺福韦,或替诺福韦联合恩曲他滨(FTC)治疗。持久病毒学应答的定义是治疗4年时的HBV DNA<69 IU/ml。在治疗应答和没有应答两组患者间,基线时的HBsAg定量没有区别,即并没有很好的预测价值(EASL 2013)。
在替诺福韦治疗中,HBsAg下降可预测最终HBsAg消失
HBsAg清除表明临床治愈,是理想的治疗终点。但在核苷(酸)类似物(NA)治疗中,HBsAg消失的比例是比较低的,在不同人群,都在10%以内。马塞兰(Marcellin)等研究显示,替诺福韦治疗中HBsAg定量的变化与最终HBsAg消失相关(EASL 2011)。在最终HBsAg消失的人群里,HBsAg定量在治疗12~24周时已经开始下降,在治疗48周时明显下降,这提示,在替诺福韦治疗人群中,HBsAg下降情况可以预测最终HBsAg消失的发生率,其中,基因D型可能表现更明显,A型、B型同样也是有预测价值的。
HBsAg定量对拉米夫定治疗应答的预测
治疗中HBsAg下降对持久应答的预测
Chan等研究显示,HBsAg定量与最终持久的应答,也有一定的相关(Antivir Ther 2011)。拉米夫定治疗的53例HBeAg(-)CHB患者,治疗时间34±23个月,停药47±35个月,持久应答的定义为停药12个月时HBV DNA≤200 IU/ml。分析有应答和没有应答人群的HBsAg下降情况及HBV DNA水平发现,在两组患者中,DNA下降的模式是类似的;但是,HBsAg定量在持久应答人群有显著下降趋势,而在没有应答人群,HBsAg下降并不明显。提示在治疗过程中,如果HBsAg下降不明显,停药以后持久应答率也相对比较低。但是此研究纳入患者例数比较少,还不足以得出HBsAg作为NA治疗应答判断指标的结论。
治疗结束时HBsAg水平对停药12个月后应答情况的预测
Chan等针对53例HBeAg(-)CHB患者研究提示,在治疗结束时,HBsAg定量≤100 IU/ml且下降幅度>1 log的患者,在停药12个月的时候, DNA都维持在低水平(HBV DNA≤200 IU/ml),即持久病毒学应答(PPV=100%);相反,如果患者在结束治疗时,HBsAg定量>100 IU/ml且下降≤1 log,那么所有患者在停药随访12个月后,都出现了复发(NPV=100%);若停药时HBsAg定量≤100 IU/ml或者下降幅度>1 log,有一半患者出现持久应答。尽管例数不多,本研究的结果还是给我们提示,在停药的时候,如果HBsAg定量≤100 IU/ml,停药后长期随访复发率会很低。因此在NA治疗中,HBsAg定量预测也有一定的意义。同一文章中,Chan等还对患者累积的持久应答发生情况进行研究。如果患者停药时,HBsAg≤100 IU/ml,停药后HBsAg继续小于2 log的比例较高;反之,复发率明显升高。
下一篇:核苷(酸)类似物对CHB患者肾功能的影响