病毒抑制联合免疫调节及其路线图
慢乙肝临床治愈新策略——病毒抑制联合免疫调节及其路线图
2018-05-25 来源:临床肝胆病杂志 我要投稿
作者:吴迪 黄达 宁琴 华中科技大学同济医学院附属同济医院
导读:抗HBV治疗的目标是延缓和减少肝失代偿、肝硬化、终末期肝病、肝细胞癌的发生,并提高CHB患者的生存率,这一目标可以通过对HBV感染获得持续免疫学控制,最终清除HBV而实现。然而,即使HBsAg阴转,肝细胞内仍有cccDNA和整合的HBV基因组稳定存在,因此彻底清除HBV,即CHB完全治愈难以实现。
血清HBsAg被认为是肝内cccDNA的替代标志物,HBsAg阴转与CHB远期预后的改善密切相关。这种情况下,即使未被完全清除的HBV在肝细胞内持续低水平存在,宿主免疫系统亦能针对仅存的被感染肝细胞产生有效的抗病毒应答。因此,目前国内外CHB防治指南推荐将治疗结束后持久的HBsAg清除,伴或不伴抗-HBs血清学转换(即功能性治愈)作为抗病毒治疗的理想终点,代表患者获得了持久的病毒学抑制和免疫学控制。这一理想的治疗终点可以针对部分患者通过个体化诊疗方案包括基线特征指导治疗(BGT)与应答指导治疗(RGT)而实现。
有效的抗病毒治疗能够持续抑制HBV复制,获得肝组织学缓解并降低肝硬化和肝癌的发生风险。目前抗病毒治疗包括2大类药物:核苷和核苷酸类药物(NAs)及干扰素(IFN)或聚乙二醇干扰素(pEG-IFN)。NAs使用方便,耐受性好,具有强效抗病毒活性,被广泛用于CHB的治疗。尽管NAs长期治疗能够显著降低cccDNA水平,然而即使是恩替卡韦(ETV)、富马酸替诺福韦酯(TDF)等一线NAs,均不能直接抑制cccDNA的转录活性,从而无法有效抑制病毒蛋白的产生,因此难以获得持久的免疫学控制,停药后病毒学复发和临床复发率高,使其需要长期甚至终身治疗。NAs长期治疗可能导致患者治疗依从性差、耐药率增加等。而IFN能够发挥双重抗病毒作用,包括促进免疫细胞活性和细胞因子表达,以及诱导IFN刺激基因的产生,后者可通过复杂的细胞内信号通路编码抗病毒蛋白。此外,IFN可通过增强HBV前基因组RNA和核心颗粒降解,或通过对cccDNA的表观遗传修饰来抑制HBV转录并减少病毒蛋白的产生。IFN的优势包括疗程有限、有效降低HBsAg滴度以及治疗应答更持久,且不会产生病毒耐药。然而,IFN仅对部分患者有效,且副作用较常见,因而限制了其临床广泛应用。
尽管持续的HBsAg阴转是CHB抗病毒治疗的理想治疗终点,但目前标准的抗病毒治疗方案难以获得HBsAg阴转,因此,新的抗病毒治疗策略如联用不同作用机制的抗病毒药物(NAs+IFN),可能帮助患者提高HBsAg阴转率甚至抗-HBs血清学转换率。
基于IFN的联合治疗
联用发挥不同抗病毒作用的NAs和PEG-IFN,可能通过直接抗病毒作用和免疫调节机制提高停药后持续应答率,从而促进NAs治疗实现安全停药。2015年亚太指南指出,NAs+PEG-IFN可能是治疗CHB的理想治疗方案。我国《慢性乙型肝炎防治指南(2015年更新版)》建议,对于NAs长期治疗并获得病毒学应答的患者,与继续NAs单药治疗相比,加用或换用PEG-IFN的治疗策略可能有助于提高HBeAg血清转换率和HBsAg下降幅度。2017年欧洲肝病学会《慢性HBV感染管理的临床实践指南》引用了我国OSST和NEW SWITCH 2项RGT的临床研究成果,陈述了NAs+IFN联合序贯治疗可显著提高CHB患者的HBsAg阴转率。
NAs+PEG-IFN初始联合治疗策略
早期PEG-IFN+拉米夫定/阿德福韦酯(ADV)初始联合治疗的相关研究表明,初始联合治疗策略仅能在治疗过程中提高病毒学应答率,但不能改善停药后的持续应答。有研究显示ADV+PEG-IFN联合治疗可显著降低病毒载量、血清HBsAg滴度和肝内HBV cccDNA水平。近期一项前瞻性随机对照研究评估了4种方案,包括TDF或PEG-IFN单药治疗、TDF+PEG-IFN联合治疗16周或48周的血清HBsAg清除率,结果表明TDF+PEG-IFN联合治疗48周的患者在治疗结束后24周时,HBsAg阴转率与TDF或PEG-IFN单药治疗相比均有所提高,其中基因A型的患者HBsAg阴转率最高。然而,尚需长期随访以评估该联合治疗方案的停药后持续应答率和远期获益。
多项研究表明,宿主遗传背景与NAs+PEG-IFN联合治疗诱导的HBsAg清除有关。近期一项针对单核苷酸多态性的全基因组筛选研究发现,对于接受ADV+PEG-IFN联合治疗的CHB患者,位于SLC16A9基因上的SNPrs12356193与治疗诱导的血清HBsAg清除密切相关。一项随机研究结果表明,对于HBeAg阴性的初治CHB患者,与PEG-IFN单药治疗相比,ETV+PEG-IFN联合治疗48周可诱导更高的病毒血症清除率,但未能提高HBsAg下降幅度和HBsAg阴转率。其中,基线HBsAg滴度<1000 IU/ml的rs3077GG基因型携带者更可能获得病毒学应答和HBsAg清除。以上研究提示宿主遗传特征可能有助于制订NAs+PEG-IFN联合个体化治疗决策。NAs(TDF除外)和PEG-IFN初始联合治疗可能难以诱导持久的治疗应答,CHB的最佳联合策略仍有待进一步探索,其中给药时机可能为影响治疗疗效的关键因素之一。
NAs序贯联合PEG-IFN治疗策略
近年多项突破性的临床研究显示,与NAs单药治疗相比,NAs序贯联合IFN的治疗策略可能提高CHB患者HBsAg清除率。一项前瞻性随机对照试验(OSST研究)显示,经过ETV长期治疗获得病毒学抑制但仍未实现HBeAg血清学转换的HBeAg阳性患者,随机分配至2组,分别继续接受ETV单药治疗或序贯PEG-IFN治疗48周,与ETV单药治疗相比,序贯PEG-IFN能够显著提高HBeAg血清学转换率和HBsAg消失率。OSST随访研究结果显示,HBeAg血清转换率从治疗结束时的17.7%提高至随访1年后的38.7%,并且85.7%的HBsAg阴转患者获得持久的HBsAg血清学清除。NEW SWITCH研究表明,经过长期NAs治疗达到病毒学抑制但尚未实现HBeAg血清学转换的HBeAg阳性患者,序贯PEG-IFN治疗可获得更高的HBsAg消失率,延长疗程为96周的HBsAg消失率高于治疗48周。近期一项概念验证性研究(Endeavor研究)评估了长期ETV治疗后获得HBeAg阴转的CHB患者,联合序贯IFN、重组人IL-2以及治疗性乙型肝炎疫苗获得HBsAg清除率情况,结果表明与IFN治疗或继续ETV治疗相比,多靶点联合治疗策略能够显著提高HBsAg阴转率。另一项随机对照试验(ARES)评估了HBeAg阳性患者经ETV单药治疗24周后加用PEG-IFN联合治疗24周的疗效,结果表明与标准ETV单药治疗48周相比,加药联合治疗未能提高治疗应答率(定义为治疗48周HBV DNA<200 IU/ml且HBeAg消失),然而其HBeAg血清学转换率更高、HBsAg水平显著下降以及停药后复发率明显降低,从而有助于NAs治疗安全停药。
越来越多的研究提示HBsAg定量可作为预测IFN治疗疗效和制订个体化治疗决策的重要标志物。OSST研究结果显示,对于ETV经治HBeAg阴转且基线HBsAg滴度较低(<1500 IU/ml)的CHB患者,推荐序贯PEG-IFN治疗,因其获得HBeAg血清学转换(33.3%)以及HBsAg清除(22.2%)的可能性较高。治疗12周时若HBsAg滴度<200 IU/ml,778%的患者可获得HBeAg血清学转换,66.7%的患者获得HBsAg清除,然而对于治疗12周时HBsAg滴度仍然>1500 IU/ml的患者,由于其获得血清学应答的几率非常小,故应考虑停用PEG-IFN治疗(图1)。因此,治疗基线或早期的HBsAg水平,是预测IFN序贯联合治疗能否获得HBsAg阴转的关键因素,同时也是帮助早期识别IFN序贯联合治疗策略优势人群的重要指标。此外,对于治疗12周200 IU/ml<HBsAg<1500 IU/ml的患者,尽管其HBeAg阴转率可达到20%,但IFN序贯联合治疗结束时HBsAg仍较低,可推荐其48周停用IFN后继续使用NAs,直至HBsAg达到较低水平,可考虑再次序贯联合IFN治疗,然而此IFN“脉冲式”治疗策略尚需临床研究进一步明确其疗效和副作用。基线低水平HBsAg是患者获得HBsAg阴转的重要因素,且IFN延长疗程可进一步提高HBsAg阴转率。
笔者团队近期开展一项大样本多中心随机对照研究(Anchor研究)纳入NAs长期治疗获得病毒学抑制且HBsAg水平<3000 IU/ml的患者,探索NAs+IFN和其他免疫调节剂的多靶点延长疗程抗病毒新方案的疗效,于2017年美国肝病年会报告了研究中期结果:较ETV单药治疗相比,ETV、长效IFN及粒细胞-巨噬细胞集落刺激因子联合序贯治疗72周可获得更高的HBsAg阴转率(18.75%)和抗-HBs阳转率(18.75%)。上述结果连同OSST、Endeavor和NEW SWITCH等4项随机对照试验临床研究结果均表明BGT、RGT的HBsAg水平可以预测NAs+IFN联合序贯治疗的临床疗效,有助于及时调整治疗方案和早期识别IFN联合治疗优势人群,提高临床治愈率(图1)。然而,对于应答相关预测因素的探索性分析仅纳入了部分患者,因此上述结果在临床推广应用之前应谨慎解读。目前在“国家十三五传染病重大专项”资助下,针对上述CHB临床治愈路线图正在开展大样本验证研究,将使其更加精准完善。
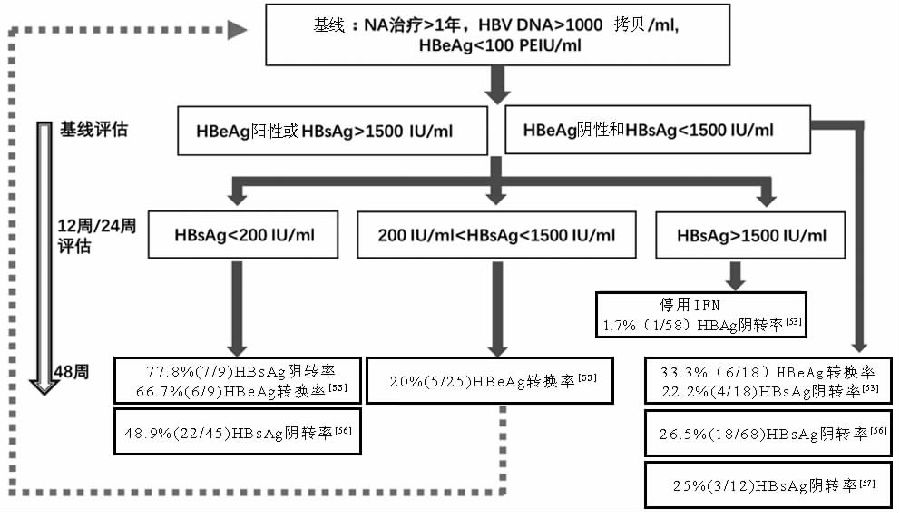
图1 NAs序贯联合PEG-IFN治疗线路图
基于IFN联合治疗所诱导的免疫修复
病毒-宿主相互作用诱导的天然和适应性抗病毒免疫反应功能失调是HBV感染慢性化的关键免疫学发病机制之一,包括自然杀伤细胞(NK细胞)活性被抑制、调节性T淋巴细胞(Treg)活化和病毒特异性细胞毒性淋巴细胞功能耗竭。多项研究强调了免疫应答在控制HBV感染中发挥的关键作用。进一步探索和明确NAs+IFN联合治疗修复受损免疫功能的相关机制可能有助于指导和完善治愈CHB的临床研究设计。
多项数据表明NAs和PEG-IFN对宿主的免疫应答发挥着不同作用。PEG-IFN主要调节天然免疫应答,尤其是NK细胞活性。Micco等评估了PGE-IFN对NK细胞和CD8+T淋巴细胞的影响,研究发现PEG-IFN可诱导IL-15产生,并促进CD56brightNK细胞的活化、扩增,从而增强其抗病毒活性,同时促进IFNγ和可溶性肿瘤坏死因子相关凋亡诱导配体的表达。然而,PEG-IFN可能导致效应性CD8+T淋巴细胞的持续消耗,对HBV特异性CD8+T淋巴细胞功能的修复作用有限。Penna等报道,PEG-IFN不能增强HBeAg阴性CHB患者早期外周血HBV特异性T淋巴细胞应答。以上数据表明PEG-IFN对天然和适应性抗病毒免疫的作用并不相同。强效的NAs治疗不能修复NK细胞的抗病毒能力,然而NAs对T淋巴细胞功能的影响不同于IFN,研究显示NAs治疗可暂时性部分修复受损的T淋巴细胞功能。近期一项研究显示,经过长期NAs治疗获得病毒学抑制的患者,受损的HBV特异性T淋巴细胞在体外培养后功能部分恢复。
越来越多的证据表明,宿主免疫功能修复是实现CHB功能性治愈的关键步骤。NAs+PEG-IFN联合治疗策略的合理性在于2类药物抗病毒作用机制不同,且对天然免疫和适应性免疫发挥不同作用,此外通过NAs抑制HBV复制可以增强PEG-IFN对天然免疫的活化作用。近期一项研究评估了高病毒载量CHB患者体内的HBV特异性T淋巴细胞功能,结果表明对于获得HBsAg清除的患者,ADV和PEG-IFN联合治疗可以诱导HBV特异性T淋巴细胞功能部分修复。由上述免疫学研究结果可以推测,长期的NAs治疗抑制HBV复制可能有助于适应性免疫应答功能的部分修复,在此基础上联用免疫调节剂如PEG-IFN可进一步增强天然免疫系统功能,从而增加抗病毒治疗成功的机会。因此NAs长期治疗后联用PEG-IFN的治疗策略有可能提高血清HBsAg清除率。同该理论假设一致,OSST研究表明PEG-IFN联合序贯治疗诱导的血清学应答与治疗24周免疫功能修复密切相关,包括CD14+单核细胞Toll样受体2表达上调、NK细胞NKG2C表达增加,以及Treg比例及其抑制功能下调等。以上结果提示,联合治疗早期免疫功能的修复和激活将有助于CHB患者实现治疗目标。此外,基于OSST研究队列,笔者团队发现抗病毒治疗早期IFN信号分子包括STAT1、MX以及负性调控因子SOCS3的表达与抗病毒治疗结束时HBsAg的下降程度显著相关。近期研究报道IFN可诱导HBV感染细胞模型中APOBEC家族基因表达并最终降解HBV cccDNA。通过研究CHB患者IFN诱导的碱基切除修复(BER)的相关基因表达与IFN抗病毒疗效的关系,获得与IFN疗效密切相关的2个BER基因:APOBEC3A和NEIL3。笔者团队发现CHB患者IFN应答与APOBEC3A表达呈正相关,而与NEIL3表达呈负相关;PEG-IFN治疗的患者其APOBEC3A~G mRNA水平均显著上调。以上免疫学指标和IFN信号分子正在“十三五”大型队列中进一步验证,探索与IFN联合治疗抗病毒疗效密切相关的分子靶点和生物标志物,将为预测和评估病毒性肝炎抗病毒疗效、寻求有效的治疗分子靶点等奠定重要理论基础。
小结
清除cccDNA和打破宿主免疫耐受是实现CHB治愈的主要障碍。只有持续深度抑制HBV复制,并诱导有效的抗病毒免疫应答,才能彻底控制HBV感染。目前,诸多全新的抗病毒治疗手段,包括针对HBV生命周期不同阶段(如HBV入胞、病毒复制、HBV cccDNA产生和病毒蛋白表达等环节)的抗病毒药物,以及提高宿主抗病毒免疫应答的免疫制剂等,正在通过动物或细胞模型进行筛选,部分已经进入早期临床试验,这些新的治疗药物将有助于进一步优化和完善现有的抗病毒治疗方案。
然而,在现阶段尚无有效清除HBV药物的情况下,可通过NAs+PEG-IFN联合治疗这一具有前景的策略优化抗病毒治疗疗效并提高临床治愈的机会。尽管目前很难确定最佳的联合治疗策略,但基于已有研究数据,先行NAs治疗能够深度抑制病毒复制,从而进一步增强IFN诱导的免疫应答,根据建议的临床治愈路线图进行个体化诊疗措施可能较NAs或PEG-IFN单药治疗获得更好疗效。在不久的将来新的抗HBV药物将被陆续批准应用于临床治疗CHB,可以设想将其与现有抗病毒药物合理联用,或可协同增强宿主免疫应答并清除cccDNA,最终实现完全治愈HBV感染的目标。近年陆续开展的Anchor、COST、OCEAN等研究均着眼于明确,NAs、IFN和免疫调节剂序贯联合治疗策略的临床疗效和长期获益,以进一步证实上述设想的合理性和可行性。
信源:吴迪,黄达,宁琴.慢性乙型肝炎临床治愈新策略——病毒抑制联合免疫调节及其路线图[J].临床肝胆病杂志, 2018, 34(5): 919-925.
下一篇:慢乙肝临床治愈(珠峰)工程项目河南启动