肝移植术并发症的病理变化
王泰龄 北京中日友好医院
目前,原位肝移植在国内已得到较广泛开展,在手术技术日臻完善的基础上,防治术后并发症,提高患者生存时间及健康质量已成为肝移植的重点课题。肝移植术后的并发症除排斥反应外,尚有多种非排斥反应性变化,包括供肝保存过程损伤、术中损伤、术后感染及原肝病复发等。有一些并发症发生于移植后即刻,有的经过2~3个月或更长时间,有些仅从临床及实验室生化改变难于断定,因而国内外将肝移植术后肝穿刺活检列为必要检查项目,并以之作为诊断、监测肝移植并发症和判断程度的金标准。本文拟就并发症的病理变化作一简介。
一、肝移植术后并发症及其发生时间
(一) 肝移植术后并发症,包括下列8类:
1. 移植排斥 分为超急性(体液)排斥、急性(细胞性)排斥和慢性(胆管消失性)排斥;
2. 功能性淤胆或采集保存损伤;
3. 肝动脉或门静脉血栓;
4. 胆管阻塞;
5. 感染及脓毒症;
6. 药物毒性;
7. 原肝病复发;
8. 肿瘤性疾病 分为移植后淋巴组织增生性疾病和肝细胞癌等。
(二) 肝移植并发症发生的时间(见图1):
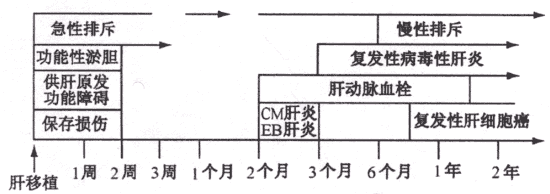
图1肝移植并发症发生的时间
二、肝移植并发症的病理变化
(一) 移植排斥
移植排斥为移植术后患者对移植物的免疫反应,其结果导致移植物损伤。肝移植的排斥反应通常分为超急性、急性及慢性3种,1994年世界胃肠病学会国际工作小组推荐按3者的组织病理类型分类,分成体液性、细胞性及胆管减少性,目前与急、慢性分类并用。
1.超急性排斥,又称体液性排斥,发生于移植后即刻或第1周之内,是由抗体/补体介导的免疫反应,较少见,可见于ABO血型不相容的供肝。移植后几小时肝内即出现血管内皮损伤,肝窦中可见中性白细胞、纤维素及红细胞聚集,伴局灶出血;于肝动脉、门静脉及肝静脉内见纤维素性血栓、血管壁坏死及白细胞浸润,免疫荧光示IgG、IgM及C3、C4或Clq沿管壁呈线性沉积。随后几天发展为肝实质的凝固性及出血性坏死,使肝脏肿大呈青紫色,多数在移植术后1~2周,亦可在2~3d内较快出现肝衰竭。
2.急性排斥,又称细胞性排斥是细胞介导的免疫反应,直接作用于胆管上皮及静脉内皮(门静脉及中央肝静脉),较常见,在70%的肝移植病人有不同程度的急性排斥,是肝移植术后早期肝功能障碍的最常见原因。一般在移植术后第1个月内到6周时发生,以7~14d为著,如免疫抑制不足或停止,也可能发生较迟。
(1) 急性排斥的发生机制及病理变化 急性排斥是由受体T淋巴细胞(TC)为供肝中抗原提呈细胞--树突状细胞(DC)的异源性抗原所激活。正常肝内DC位于小胆管及门静脉小支以及中央静脉周围终末输入淋巴管的支持胶原束之间。移植术后即可见TC在DC周围簇聚,并为之活化,48h内开始分裂,分泌细胞因子,并吸引更多炎细胞,同时引起小胆管及静脉内皮损伤,形成急性排斥特有的病理变化--三联病变。① 汇管区混合细胞浸润:除淋巴细胞及淋巴母细胞外,有巨噬细胞、浆细胞、中性粒细胞及嗜酸性白细胞浸润。排斥反应越重,浸润细胞中的活化淋巴细胞及嗜酸性白细胞越多,并可浸润于汇管区周围肝细胞间。② 小胆管损伤:炎细胞围绕并侵入小胆管上皮,胆管上皮细胞胞浆内出现空泡,胞核大小不等,一些细胞凋亡脱失,基底膜局灶破坏,或致小胆管残缺不整。③ 内皮炎:门静脉及(或)中央静脉内皮下淋巴细胞浸润,内皮细胞被掀起离开基底膜,内皮细胞肿胀、脱落,表面或有炎细胞粘附。严重的排斥反应累及肝细胞,小叶内出现局灶坏死,甚至中央静脉周围肝细胞坏死。适当治疗急性排斥反应可以消退,如持续及(或)多次急性排斥,可引起较多小胆管缺失,进入慢性排斥。
(2) 急性排斥的分级标准 急性排斥的三联病变比较恒定,为统一对病变严重程度的划分,制定了分级标准。将病变按程度分为Ⅰ-Ⅲ级,对病变程度轻,尚未达Ⅰ级诊断标准的定为“不肯定的急性排斥”(见表1)。
表1急性肝移植排斥反应的分级 分级标准未定汇管区炎症浸润,但尚未达到急性排斥的诊断标准轻度(Ⅰ级)排斥反应波及少部(<50%)汇管区,均较轻,并限于汇管区内中度(Ⅱ级)排斥反应波及大部(>50%)汇管区,使之扩大重度(Ⅲ级) 中度基础上,炎症波及汇管区周围带,中-重度肝静脉周围炎症伴肝细胞坏死
1995年在加拿大Banff城由肝移植病理、内科、外科专家共同研究对3项病变的分级计分标准,几经协商提出了Banff分级计分方案。将3项病变按各自的危害程度分别予以1~3分,3项分值的总和称为排斥活动指数(Rejection Activity Index,RAI),RAI≤4为轻度急性排斥;RAI 5~6为中度;RAI 7~9为重度,并提出常规病理报告中应注明RAI分值。经多方验证,RAI重复性好,用作前后肝穿的对比有较好的实用价值,已广为采用(见附表2)。
有关专家曾以50例肝移植后肝穿标本以分级方法与Banff RAI进行评估,结果两者间无差异。
3.慢性排斥,又称胆管消失性排斥(DR)或胆管消失综合征,较急性排斥少见,据不同单位的统计,发生率自2.4%~16.8%,并证明随免疫抑制剂的成功应用,发生率有明显下降。慢性排斥发生于移植术后数周到几年,最早发生于移植后2周,最多见于3~4个月。根据发生时间临床再分之为早期(6周以内)、迟发(6周~6个月)及晚期(6个月以上)3种。慢性排斥多继于重度急性排斥未曾消散、多次急性排斥发作或亚临床的持续性细胞性排斥。病理变化有两大特点:①小胆管和中等大小胆管消失,为慢性排斥的主要病变,因而慢性排斥又称DR。诊断胆管消失的标准是:在连续肝穿组织内找到20或20个以上的汇管区,其中50%以上看不到小胆管(最近一项双盲研究证明平均观察到8.4个汇管区,诊断即较可靠)。为了保证观察到一定汇管区数量,以取2条或2条以上肝穿组织送检为宜。DR早期,由于细胞排斥仍占优势,不易看出小胆管消失,可以应用CK19免疫组化染色,观察是否有小胆管上皮细胞残留。其后,小胆管消失、汇管区炎症减轻,其中仅有少量淋巴细胞浸润,可见到肝小动脉,而不见伴行小胆管,有时二者均消失,只剩纤维组织。DR常伴明显的肝小叶内毛细胆管淤胆,可为弥漫性或仅限于3带。②排斥性动脉病变,称为泡沫细胞性动脉炎或动脉病,又称血管性排斥(VR)。可能由于动脉内皮受免疫损伤,血中脂质沉积内皮下,巨噬细胞吞噬脂质后,形成泡沫细胞簇集于动脉内膜,致动脉管腔狭窄或闭塞。由于泡沫细胞性动脉病变主要发生于大汇管区及近肝门的较大动脉枝,故在肝穿活检中难以见到,但可见因动脉病变血供减少引起的肝小叶3带缺血、坏死或纤维化。此外由于肝内大小胆管均为肝动脉分支供血,故缺血可致小胆管坏死、消失。如反复活检均见到静脉周围3区坏死,提示预后不好。
表2急性排斥反应的Banff分级计分方案
病变标准计分少数汇管区受累,主要为淋巴细胞浸润,汇管区未见明显扩大1汇管区炎症大部或全部汇管区扩大,混合性炎细胞浸润,包括淋巴细胞、个别淋巴母细胞,中性粒细胞及嗜酸性粒细胞2大部或全部汇管区显著扩大,混合性炎细胞浸润,包括多量淋巴母细胞及嗜酸性粒细胞,浸润至汇管区周围肝实质3少数胆管周围炎细胞浸润,上皮细胞轻度变化,如核/浆比值增高1胆道炎症/损伤大部或全部胆管有炎细胞浸润,有的胆管上皮退变,核多形、极性紊乱、胞浆内空泡形成2同上,大部或全部胆管有退变,胆管灶状破坏3部分小叶间门静脉和/或中央静脉内皮下淋巴细胞浸润1静脉内皮炎症大部或全部小叶间门静脉和/或中央静脉内皮下炎细胞浸润2同上,伴中、重度中央静脉周围炎症并延伸至邻近肝实质、伴中央静脉周围肝细胞坏死3
慢性排斥的胆管消失及动脉病变可单独发生,但常同时存在,致小胆管消失及纤维化严重,同时肝实质呈进行性淤胆。大多不可逆,而需要再移植。Demetris等报告在早期小胆管消失<25%且无小叶中心缺血性改变时,用FK506可使淤胆逆转,也有少数患者的慢性排斥反应可以自动消退,并有胆管再生。
(二) 功能性淤胆或采集保存损伤
功能性淤胆为肝移植所特有与排斥反应或用药无关。多发生于移植术后2周内,约见于25%的病人,系供肝保存过程冷冻缺血,肝细胞受损,当血液再灌后细胞出现变性,影响肝内胆汁流动障碍,因是一过性故称功能性淤胆。组织学可见肝小叶毛细胆管及肝细胞内淤胆,伴肝细胞明显的气球样变或羽毛样变,主见于腺泡2、3带,与未受累的1带分界明显。汇管区多正常。功能性淤胆的病变主要发生于肝实质,故易与急性排斥相区别,后者病变主要在汇管区。
(三) 缺血性损伤
1. 围手术期低灌损伤除引起肝腺泡3带缺血坏死外,有时在肝包膜下引起不规则的带状梗死,多为非连续性,并不重要,故活检中见到这种梗死,并不意味移植失败。
2. 原发性移植物功能障碍(PGD)通常发生于移植后第一周,一般没有可见的血管堵塞或其它明显原因。发生机制可能和许多因素有关,如缺血灌流损伤、所用灌流液的类型,术中出现凝血问题、代谢性酸中毒等。供肝年龄的增长与PGD发生率明显相关。PGD的程度轻重不一,可以很轻或原发性无功能,严重者肝活检可见弥漫性缺血性凝固坏死,但坏死程度较梗死为小,汇管区仍保留。需靠影像学检查明确坏死范围(限局、亚大块或大块坏死)。
3. 肝动脉血栓或狭窄可发生于移植术后数日、数周或数月。肝动脉血栓引起的缺血性坏死为肝实质的凝固性坏死,界限清楚。因肝内大小胆管均为肝动脉分支供血,还引起缺血性胆管损伤。如早期即发生血栓可致肝实质广泛梗死,立即需第二次移植;如肝动脉血流逐渐减少(泡沫细胞性动脉炎、动脉病或血栓)。有时间形成侧枝,可仅呈轻度小叶中心缺血,但所引起的胆管损伤常继续进展,终影响移植肝的功能。
4. 肝静脉血栓或流出受阻,组织学上可见肝腺泡3区淤血,红细胞漏出于肝细胞板之间,出现这些改变时,需请临床作进一步观察。
(四) 胆管阻塞
是肝移植后功能障碍及失败的重要原因,其发生率各移植中心不一,约在10%~20%之间,除肝外胆管吻合技术问题外,最常见的原因是移植时意外损伤了胆管的小动脉,肝动脉血栓亦可引起肝外胆管坏死、阻塞。肝活检最早期的改变为小叶中心毛细胆管淤胆,汇管区水肿,其后细胆管增生,中性白细胞浸润。见到细胆管增生,应引起警惕,需进行胆管造影,检测胆管吻合状态。移植失败后取出的肝标本结合胆管造影定位,标记狭窄部位、取材。组织学可见胆管粘膜上皮剥脱,管壁坏死,局部急性炎症反应,并有胆汁漏出。
(五) 机会感染
肝移植后强效免疫抑制剂的应用可使许多患者发生机会感染,包括病毒、细菌、原虫与真菌感染。感染限于肝内或累及其它器官。
1. 病毒感染巨细胞病毒(CHV)肝炎较常见,可于移植后1~2个月发生,病变特点为肝小叶内出现微小脓肿,在肝细胞、胆管上皮及内皮细胞胞浆内见MCV包涵体。免疫组化染色可进一步确定病毒抗原。有时可见上皮细胞样肉芽肿。其次为EB病毒肝炎,多发生于术后1~4个月,病变特点为汇管区及肝窦内出现异型淋巴细胞。它与急性排斥的区别为汇管区浸润细胞单一,主要为B淋巴细胞(急性排斥主要为T淋巴细胞);不见小胆管损伤及内皮炎或极轻微;肝窦内异型淋巴细胞成串,不伴周围肝细胞损伤。EBV肝炎可消退或进展为移植后淋巴增生性病变,致汇管区扩大,其中有致密的异型淋巴细胞浸润,扩大汇管区变园压迫周围肝细胞,窦内及中央静脉周围亦见同样细胞浸润。用免疫组化或PCR检测EBV DNA或原位杂交检测EBV RNA,有助诊断。
2. 细菌感染大部细菌感染均为肝外肠道细菌所致,最常见部位为胆管,常伴发于肝动脉血栓或其它血管病变。肝活检可见汇管区水肿、中性白细胞浸润为主的胆管炎。
(六) 药物毒性
肝移植患者所应用的免疫抑制药有的有潜在肝毒性作用。
1.硫唑嘌呤(Azathioprine)首先报告于肾移植患者应用此药有肝毒性,于肝移植应用此药曾有报导可致血清转氨酶升高,肝窦充血及肝腺泡3区肝细胞坏死或终末肝静脉纤维化,特别是伴有急性排斥反应出现血管内皮炎的患者。
2. 孢菌素(Cyclosporin)本药可抑制ATP依赖性胆盐运输,因而可能引起肝细胞及毛细胆管内淤胆。
3.FK506虽然亦可引起肝细胞及毛细胆管内淤胆,但极罕见,可能与所需剂量较低有关。
(七) 原肝病复发
1. 乙型病毒性肝炎(HB)复发移植术前,患者HBV抗原阳性,特别是HBV DNA阳性者,常有复发,如术前无病毒复制或术前较长时间应用乙肝免疫球蛋白(HBIg),可以明显减少复发。复发后的HB与非移植患者HB不同,肝穿活检证实,最早的改变为结构近于正常的肝细胞内出现HBsAg及HbeAg,最早可见于移植后2~5周,平均118天,而非移植的急性HB,见不到HBsAg及HbeAg。其后病变进展迅速,约75%~90%肝细胞内可见病毒抗原。一部分患者临床呈慢性携带状态。大部在平均156天(115天~307天)左右肝内发生炎症性改变。肝细胞肿胀呈气球要变,可见大、小泡性脂变,3区肿胀肝细胞淤胆,其间可见坏死灶及嗜酸小体(凋亡小体),汇管区炎症,伴周围碎屑坏死及纤维化,呈慢性活动性肝炎的改变。约25%患者,病变进展迅速,特称为纤维化性胆汁淤积性肝炎(FCH)。一般在移植后7个月出现明显的组织学变化,肝细胞肿大,含有大量毛玻璃样包涵体,HBsAg以及HBcAg;肝细胞变性坏死,其间见少量单个核细胞浸润,肝细胞间胶原纤维沉积,常贯通小叶中心与汇管区。大部在一年内发生肝衰竭。FCH患者第二次肝移植后,病变发展尤速,可以在2个月出现肝衰竭。FCH亦可发生于肾移植术后,可能与患者术前HB病毒复制水平高,术后应用大剂量免疫抑制剂有关。HB合并HDV感染,移植后数周到数月,可有HDV再感染,合并HDV感染可以使复发性HB预后改善。
2. 丙型病毒性肝炎(HC)复发 晚期HC作肝移植后,移植肝可发生HC,通常病变较轻,发生于术后第一年末或第二年,病理表现为汇管区淋巴细胞聚集,轻度汇管区周围炎,伴或不伴肝细胞脂变,小叶内可见较多凋亡小体。少数HC病变较重,肝细胞呈气球样变,进行性淤胆,融合坏死,以及桥接纤维化和肝硬化,有的可类似复发HB的纤维性胆汁淤积性肝炎。复发HC需与急性排斥相鉴别,后者汇管区的炎细胞浸润以小胆管为中心,小胆管损伤及静脉内皮炎均较HC为明显,但汇管区周围炎症及小叶内炎症一般较HC为轻。难于鉴别时,可作免疫组化或PCR证明肝组织内有HCV RNA。
3. 自身免疫性肝炎(AIH)复发 自身免疫性肝炎移植术后可以复发,但不多见。如临床血清球蛋白升高,出现自身抗体,转氨酶升高,肝穿活检示汇管区炎症及界面炎(在汇管区周围见有淋巴细胞及浆细胞浸润)则可确诊为复发,也有的复发后首先呈现小叶性肝炎。儿童的AIH复发常呈进行性加重,移植后一年内出现肝硬化。
4. 原发性胆汁性肝硬化(PBC)复发PBC移植术后约10%~20%的患者复发,但病程很轻,仅少数发生肝硬化。移植术后血清抗线粒体抗体仍持续存在或再次升高,肝功能检测血清ALP升高加速,肝穿病理见小叶间胆管损伤,特别是见到旺炽性胆管病变伴上皮样肉芽肿形成,可确诊为PBC复发。借出现上皮样肉芽肿可以和排斥反应相鉴别。此外细胆管增生及进行性铜沉积亦有助诊断。但值得注意有的术后血清AMA持续存在,而无PBC复发,亦有几例PBC移植术后发生AIH。
5. 原发性硬化性胆管炎(PSC)复发 PSC移植术后复发率为20%,发生较迟,需靠胆管造影确定,但是须严格排除其它胆管并发症,如术后吻合堵塞或动脉血栓后缺血均能引起同样改变,最可靠的依据是组织学的纤维闭塞性胆管炎。
6. 代谢性疾病肝内酶缺乏所引起的代谢性疾病,移植术后不再复发,如α1-抗胰蛋白酶缺乏症,Wilson病,血友病A、B,高酪氨酸血症。但是IV型糖原沉积病,家族性高胆固醇血症及红细胞生成性卟啉病等在肝移植后不能彻底治愈。在红细胞生成性卟啉病植入肝内可有卟啉的逐渐沉积。关于遗传性血色病移植后的报导尚不足,但是血色病的变异基因(HFE基因)的蛋白产物在肠上皮表达,故可预料铁吸收异常在肝移植后仍将持续,曾有报导,移植后肝活检组织内可见铁质再沉积。
(八) 肿瘤性疾病
1. 移植后淋巴组织增生性疾病 淋巴组织增生占肝移植病人的1%~2%,小儿达8%,大部可查找到与EB病毒有关,可能是由于免疫抑制剂使T细胞调节不全所致。此期,浸润细胞仍为多克隆的,用免疫抑制药及抗病毒药均有效,当克隆突变即进入恶性期。淋巴组织肿瘤性增生多为脏器移植术后进行免疫抑制治疗的并发症,主要为B细胞淋巴瘤。曾有报告肝移植后2个月肝内发生淋巴瘤,通常淋巴瘤源自受体淋巴组织,罕源自供肝内淋巴组织,淋巴瘤细胞浸润于汇管区或在肝内形成弥漫的瘤结节。
2. 肝细胞癌 主要见于慢性乙、丙型肝炎移植后。可为原位发生或复发,如原肝癌较小移植后预后较好,如肿瘤较大或术前患者已出现症状,60%~80%复发,肝及肺为常见的复发部位。胆管细胞癌因极易复发,故禁忌进行肝移植,其它一些不常见的肿瘤偶亦作肝移植,虽不可避免的要复发,但可使患者在一段时间内保持其生活质量。
下一篇:肝移植病人的术后处理