肝细胞癌的分子靶向治疗
复旦大学附属中山医院肝癌研究所 叶胜龙
1 肝细胞癌靶向治疗的分子基础
针对肿瘤的特异性分子靶点设计的抗肿瘤治疗,具有特异性强、疗效明显、正常组织损伤少的优点。肿瘤分子靶向治疗主要包括信号传导通路抑制剂、生长因子及其受体抑制剂、新生血管生成抑制剂、单克隆抗体、细胞周期调控和基因治疗(反义癌基因寡核苷酸、抑癌基因和基因-病毒治疗)等方面。研究表明,肝细胞癌(HCC)组织中表皮生长因子受体(EGFR)、血管内皮细胞生长因子受体(VEGFR)、血小板源性生长因子受体(PDGFR)和Ras/Raf/MEK/ERK、PI3K/AKT/mTOR等信号传导通路均呈高表达,在HCC的发生、发展进程中起重要作用,因而是肝癌治疗的潜在分子靶点。信号传导通路主要包括细胞外因子(生长因子、细胞因子、肿瘤坏死因子等)、受体(酪氨酸激酶受体、G蛋白联接受体、黏附因子等)、联结蛋白、G蛋白(RAS蛋白)、第二信使(cAMP、cGMP、DAG等)、胞内激酶(丝氨酸/苏氨酸激酶、PKA、PKC等)和核受体。目前已知最终的通路是酪氨酸激酶受体通路,几乎所有的生长因子刺激细胞增殖的信号以及大部分细胞因子的信号、抗原结合淋巴细胞表面受体诱发细胞各种反应,都离不开酪氨酸激酶受体。胞浆内的激酶大多是丝氨酸/苏氨酸激酶,与细胞生长关系最密切的是MAPK/ERK通路。在HCC中,配体EGF、肝细胞生长因子(HGF)、PDGF、VEGF等其他因子通过激活MAPK通路使控制细胞增殖关键的c-fos和c-jun基因转录。EGFR通过结合酪氨酸激酶从而激活其活性并启动信号传导,最终使基因开始产生点突变、扩增以及增加配体和受体之间的作用。通过以上因子的共同作用激活肝细胞内MAPK通路有可能是导致HCC形成的关键原因。
2 肝细胞癌分子靶向治疗的探索
EGFR抑制剂 EGFR是目前研究最多的分子靶点。许多肿瘤细胞有EGFR的表达或高表达,其往往预示侵袭性高、进展迅速、预后不良。EGFR与EGF结合后可促进细胞的分裂增殖,并可使正常细胞恶变,还可影响肿瘤血管及间质的生长,促进肿瘤的转移和复发。研究表明,HCC中存在EGFR的高表达,与肝癌的形成、发生和发展有密切的关系。因此EGFR可能成为HCC治疗的靶点。吉非替尼是选择性EGFR酪氨酸激酶抑制剂,近年实验研究表明,将吉非替尼作用于肝癌细胞,可阻止其生长,还能阻止基质金属蛋白酶MMP-9的生成,提示可抑制肝癌的转移。厄洛替尼是特异的EGFR酪氨酸激酶ATP竞争性抑制剂,体内外资料均表明其能选择性抑制EGF介导的肿瘤细胞增殖,具有显著的抑瘤活性。近期进行的临床Ⅱ期试验初步结果表明,厄洛替尼对部分HCC患者有一定疗效。
抗血管生成药物 恶性肿瘤的生长和转移与肿瘤区域的血管生成密切相关。肿瘤部位新生血管高表达肿瘤特有的VEGFR,因而可以作为血管靶向治疗的理想靶点。HCC组织VEGF呈高表达,并在肝癌的发生、发展进程中起重要作用。贝伐单抗通过特异性抑制恶性肿瘤中高表达的VEGFR阻断肿瘤的血液供应,使肿瘤不能在体内播散,临床初步应用提示,其对不能切除的局限性HCC有一定疗效。舒尼替尼通过同时抑制VEGFR和PDGFR双靶点来阻断肿瘤血管生成,抑制HCC增殖,临床应用表明,其可致HCC组织缺血坏死,肿瘤生长减慢,使患者生存期和疾病进展时间(TTP)延长。我所在高转移人肝癌原位移植裸鼠模型上,用改进优化的噬菌体文库体内展示技术筛选出HCC肿瘤血管特异性靶向分子LCI-X7肽,可能在肝癌转移、复发诊断及靶向治疗等方面有较大的潜在应用价值。
基因靶向治疗药物 基因靶向治疗的探索目前主要处于实验研究阶段并已取得显著进展。有研究表明,针对EGFR的非病毒型基因导入系统可靶向性地与EGFR结合从而将目的基因转导入肿瘤细胞,在高转移人HCC裸鼠模型中显著抑制肝癌的生长,而肿瘤肝内播散及腹壁、腹腔淋巴结、肺转移均明显减少,表明EGFR介导的基因治疗有望在预防复发转移方面发挥作用。应用2’MOE修饰的反义stat3寡核苷酸能特异性抑制人HCC细胞stat3的表达,显著抑制高转移人肝癌细胞的生长、侵袭转移和血管生成,并明显延长荷瘤宿主的生存期。肿瘤基因-病毒治疗利用肿瘤增殖病毒在肿瘤细胞中的特异性增殖,高效表达抗肿瘤基因,其疗效明显优于单一的肿瘤增殖病毒治疗或传统的肿瘤基因治疗。利用甲胎蛋白(AFP)启动子结合隔离子等基因转录调控元件,构建特异性针对表达AFP原发性肝癌细胞的溶瘤腺病毒载体,在体外细胞及动物体内肿瘤模型中均可特异性靶向杀伤肝癌细胞。利用基因重组技术构建人端粒酶逆转录酶启动子控制腺病毒E1A基因表达并携带内皮抑素基因的基因-病毒系统,能在端粒酶阳性的肝癌细胞中特异性增殖并高效表达内皮抑素基因,对肝癌生长具有很强的抑制作用。
3 索拉非尼引领肝细胞癌分子靶向治疗的研发
近年来尤为瞩目的进展是索拉非尼(多吉美)对HCC的靶向治疗。索拉非尼是一种多激酶抑制剂,一方面通过抑制RAF-1激酶和B-RAF激酶,从而抑制ERK的磷酸化进而抑制整个MAPK通路信号的传导,可达到抑制肿瘤细胞增殖作用的目的;另一方面还可抑制细胞表面VEGFR-2、VEGFR-3、PDGFR
-β、FLT-3和c-KIT受体的自身磷酸化因而影响下游酪氨酸激酶活性,从而抑制肿瘤新生血管生成,所以,索拉非尼具有双重抑制MAPK信号传导通路的作用。
索拉非尼治疗晚期HCC患者的Ⅱ期临床试验表明,35%的患者疾病稳定达4个月,中位总生存(OS)期为9.7个月。其中磷酸化ERK(p-ERK)免疫染色阳性(提示Ras信号传导通路活化)患者的TTP为178天,而染色阴性者为46天。在欧美国家进行的国际多中心随机双盲安慰剂对照Ⅲ期临床试验表明,索拉非尼治疗组与安慰剂组的中位OS期分别为10.7、7.9个月(P<0.001),中位TTP分别为5.5、2.8个月(P<0.001)。其后在以我国为主的亚太地区进行的同样的多中心随机双盲对照Ⅲ期临床试验证实,索拉非尼治疗组与安慰剂组的中位OS期分别为6.5、4.3个月(P=0.014),中位TTP分别为2.8、1.4个月(P<0.001)。这两项大规模多中心临床研究的患者病情不同(与欧美患者比较,亚太地区患者多为乙肝病毒感染、肿瘤多为多结节、病期更晚、肺转移更多),但二者取得基本一致的临床结果:索拉非尼治疗欧美和亚太地区晚期HCC患者的中位OS期分别延长44%和47%,TTP分别延长74%和73%,风险比(HR)相似(OS的HR分别为0.69和0.68,TTP的HR分别为0.58和0.57),严重不良反应的发生率也相似,主要为腹泻、手足皮肤反应、脱发等,且大多安全耐受。两项研究及其亚组分析比较显示,索拉非尼在不同人种、地域、肝病背景、病期及不同程度血管浸润和远处转移的HCC患者中均能取得相似疗效。索拉非尼是循证医学证实可延长HCC患者生存期的首个全身治疗药物。2008版美国国立综合癌症网络(NCCN)的指南推荐索拉非尼作为晚期HCC的一线治疗用药,欧洲药品管理局(EMEA)和美国食品药品管理局(FDA)于2007年先后批准索拉非尼用于治疗无法手术切除的HCC。我国食品与药品监督管理局(SFDA)于2008年批准索拉非尼用于治疗无法手术切除或远处转移的HCC。目前正在进一步探索索拉非尼与其他抗肿瘤治疗的联合应用,包括与化疗药物或其他分子靶向药物联合治疗晚期HCC、与肝动脉化疗栓塞联合治疗中期HCC、以及根治性治疗(肝切除术或局部消融术)后辅助治疗预防复发等途径。
其他分子靶向药物如厄洛替尼和吉非替尼、舒尼替尼、依维莫司、贝伐单抗等治疗HCC的Ⅱ期临床研究也取得初步疗效。此外,一些新的分子靶向治疗药物即将进入临床试验。相信随着临床研究的深入,分子靶向治疗有望进一步提高疗效,为肝癌患者带来新的希望。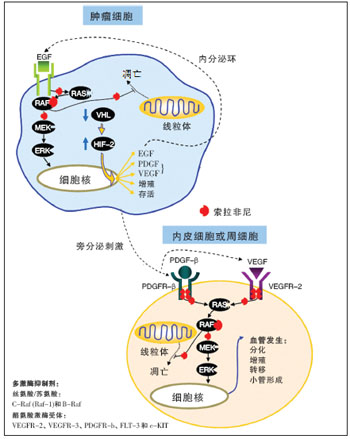 图 索拉非尼:抗肿瘤血管生成及肿瘤细胞增殖
图 索拉非尼:抗肿瘤血管生成及肿瘤细胞增殖
责任编辑 廖莉莉
下一篇:肝细胞癌放射治疗经验共享